Arenele
Hidrocarburile
aromatice au numele generic de arene. Ele
contin in molecula lor unul sau mai multe
cicluri alcatuite din sase atomi de
carbon. cand molecula este formata
dintr-un singur ciclu, hidrocarburile
sunt mononucleare; cand molecula cuprinde
mai multe cicluri, hidrocarburile sunt
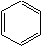
polinucleare. Cea mai simpla hidrocarbura
aromatica, benzenul are molecula
alcatuita dintr-un singur asemenea ciclu;
formula ei este C6H6. Reprezentarea
benzenului printr-un ciclu de sase atomi
de carbon cu trei duble legaturi
conjugate a fost propusa de Kekulé in
1865:
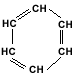
In
sprijinul acestei reprezintari vin unele
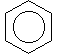
proprietati ale benzenului. Astfel in
conditii speciale, benzenul poate fi
hidrogenat dand ciclohexan:
Tot
asa, sub influenta luminii, clorul sau
bromul se aditioneaza la molecula
benzenului dand hexaclorciclohexan: C6H6
+ 3Cl2 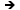 C6H6Cl6. Cu ozonul, benzenul
da o trizonida, care prin descopunere cu
apa, trece in glicoxal. Aceste reactii de
aditie dovedesc urmatoarele: benzenul are
un ciclu de sase atomi de carbon; in
ciclu exista trei duble legaturi.
Reactiile de aditite la benzen au loc
insa numai in conditii speciale; in mod
obisnuit, benzenul da de preferinta
reactii de substitutie, ca de exemplu: C6H6Cl6. Cu ozonul, benzenul
da o trizonida, care prin descopunere cu
apa, trece in glicoxal. Aceste reactii de
aditie dovedesc urmatoarele: benzenul are
un ciclu de sase atomi de carbon; in
ciclu exista trei duble legaturi.
Reactiile de aditite la benzen au loc
insa numai in conditii speciale; in mod
obisnuit, benzenul da de preferinta
reactii de substitutie, ca de exemplu:
cu
halogenii:
C6H6
+ Cl2 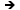 C6H5Cl +
HCl C6H5Cl +
HCl |
cu
acid sulfuric:
C6H6
+ HO-SO3H 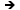 C6H5-SO3H
+ H2O C6H5-SO3H
+ H2O |
cu
acid azotic: C6H6
+ HO-NO2 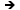 C6H5-NO2 +
H2O C6H5-NO2 +
H2O |
Formarea cu usurinta a produselor de
substitutie este o dovada ca la benzen nu
predomina caracterul nesatural intalnit
la hidrocarburile cu duble legaturi
conjugate, ci, dimpotriva, benzenul are
si un caracter saturat, pronuntat.
Aceasta comportare nu este insa in
concordanta cu formula de structura a lui
Kekulé, la care exista trei duble
legaturi conjugate. O alta critica care
se mai aduce acestei formule este ca ea
prevede existenta mai multor izomeri
decat sunt in realitate.
Daca se considera inlocuiti doi atomi de
hidrogen din molecula benzenului, cu
atomi de brom, atunci, conform formularii
lui Kekulé, ar trebui sa existe doi
izomeri care contin atomii de brom legati
de doi atomi de carbon vecini (in
pozitiile 1,2 si 1,6), la unul, cei doi
atomi de carbon fiind despartiti printr-o
legatura dubla si la celalalt, printr-o
legatura simpla. In realitate, asemenea
izomeri datoriti exclusiv pozitiei dublei
legaturi nu se cunosc. Simetria ciclului
benzenic cunoscuta actual ilustreaza
existenta a numai unui singur produs
disubstituit in pozitia 1,2, contrar
reprezentarii dupa care benzenul ar avea
o structura de 1,3,5-ciclohexatriena.
Exista trei izomeri ai dibrombenzenului
datoriti substitutiei bromului la
diferite pozitii ale ciclului. Ei au
puncte de fierbere foarte diferite. La
unul din acesti izomeri (cu punctul de
topire = 1.8 grade C), cei doi atomi de
brom sunt legati de atomii de carbon
vecini; la al doilea izomer (cu punctul
de topire = -7 grade C), atomii de brom
sunt legati de doi atomi de carbon intre
care exista o grupa CH cu atomul de
hidrogen nesubstituit; la al treilea
izomer (cu punctul de topire = 87 grade
C), atmoii de brom sunt legati de doi
atomi de carbon despartiti prin doua
grupe CH cu atomii de hidrogen
nesubstituiti. De aici s-a tras concluzia
ca pozitiile 1,2 si 1,6 sunt echivalente
intre ele, dupa cum si in pozitiile 1,3
si 1,5 sunt echivalente:
Kekulé a
incercat in 1872 sa explice
necorespondenta intre numarul izomerilor
derivati disubstituiti ai benzenului
rezultati din formula lui si cei
existenti in realitate, emitand ipoteza
ca in molecula, dublele legaturi nu ocupa
locuri fixe, ci isi schimba locul cu
legaturile simple, adica se deplaseaza,
"oscileaza".
Numeroase fapte experimentale au dovedit,
insa, ca in molecula benzenului toate
legaturile sunt echivalente intre ele si
deci nu sunt trei legaturi simple si trei
duble.
Intrucat formula lui Kekulé nu exprima
echivalenta legaturilor C-C din molecula
benzenului si nici proprietatea
importanta a benzenului de a da
privilegiat reactii de substitutie si nu
reactii de aditie, asa cum arata dublele
legaturi din formula, unii cercetatori au
cautat sa explice structura benzenului
prin alte diferite tipuri de
reprezentari, care sa reflecte
proprietati caracteristice ale
benzenului.
Clasificare
 |
 |
 |
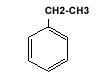 |
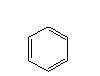
| Benzen |
Toluen |
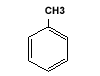
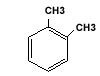
Orto-Xilen |
Etilbenzen |
| MONONUCLEARE |
| |
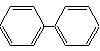 |
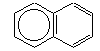 |
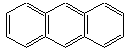 |
| Difenil |
Naftalina |
Antracen |
| POLINUCLEARE |
Nomenclatura
La
hidrocarburile aromatice mononucleare,
capul seriei este benzenul, C6H6.
Omologii superiori ai benzenului sunt:
metilbenzenul, cunoscut sub numele de
toluen, etilbenzenul, n-propilbenzenul,
izopropilbenzenul (cumen) etc. Avand in
vedere ca in benzen toate grupele CH sunt
echivalente, nu poate exista decat un
singur derivat monosubstituit.
Denumirea
arenelor se face prin adaugarea numelui
substituentilor la terminatia -benzen.
Derivatii disubstituiti ai benzenului se
denumesc uzual prin intermediul
prefixelor orto (o-), para (p-) si meta
(m-). Daca benzenul este substituit cu
doi radicali diferiti, numerotarea si
denumirea acestora se face in ordine
alfabetica.
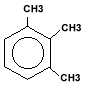 |
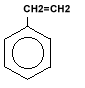 |
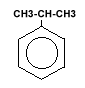 |
| 1,2,3-trimetilbenzen |
Fenilbenzen
- stiren |
Cumen |
Metode de
obtinere
1. Trimerizarea
alchinelor
2. Reformarea
catalitica a n-alcanilor
CH3-CH2-CH2-CH2-CH2-CH3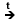 4H2 + 4H2 + |
 |
3. Alchilarea
arenelor (reactie de substitutie) -
alchilarea Friedel Crafts
Ar-H
+ R-X 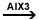 HX + Ar-R -
X=Cl,Br,I HX + Ar-R -
X=Cl,Br,I
4. Distilarea
uscata a gudronului de carbune
5. Din petrol
Reactii
chimice
1. Hidrogenarea
(catalizator Ni/Pt/Pd), conditii
energice, temperatura
2. Halogenarea
(Cl2,Br2 - la lumina)
 |
+3Cl2 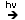 hexaclorciclohexan
(HCH) hexaclorciclohexan
(HCH) |
3. Reactia de
substitutie la nucleu
Ar-H
+ XY 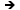 Ar-X + HY Ar-X + HY
4. Reactia de
alchilare
Ar-H
+ R-X 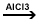 HX + Ar-R HX + Ar-R
5. Reactia de
halogenare (FeX3 - catalizator,
X=Cl,Br,I)
Ar-H
+ Cl2 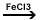 HCl + Ar-Cl
(clorbenzen) HCl + Ar-Cl
(clorbenzen)
Ar-H
+ Br2 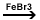 HBr + Ar-Br
(brombenzen) HBr + Ar-Br
(brombenzen)
6. Reactia de
nitrare (solutie de HNO3 foarte
concentrat si solutie de H2SO4 foarte
concentrat)
Ar-H
+ HNO3 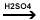 H2O + H2O + |
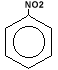 |
7. Reactia de
sulfonare
Ar-H
+ H2SO4 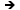 Ar-SO3H + H20 (reactia de
sulfonare este reversibila) Ar-SO3H + H20 (reactia de
sulfonare este reversibila)
8. Reactii la
catena laterala, in pozitia benzilica (cu
Cl2, Br2, la lumina)
9. Reactia de
oxidare
a)
Completa (arderea/combustia)
C6H6
+ 15/2 O2 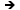 6 CO2 + 3 H2 + Q 6 CO2 + 3 H2 + Q
b)
Incompleta
1.
La nucleu
 |
+ 9/2 O2
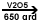 2 CO2 +
H2O 2 CO2 +
H2O |
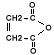 |
(anhidrida) |
2.
La catena laterala in pozitia benzilica
Ar-CH3
+ 3/2 O2 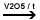 Ar-COOH + 2 H2O Ar-COOH + 2 H2O
Proprietati
fizice
Hidrocarburile
aromatice mononucleare sunt lichide
incolore, cu miros dulceag si
patrunzator. Ele sunt insolubile in apa,
dar sunt miscible in orice proportie cu
dizolvanti organici (alcooli, eteri,
etc.). Punctele lor de fierbere sunt
cuprinse intre 80 si 300 grade C. In
general omologii benzenului au
proprietati asemanatoare cu cele ale
benzenului, insa pe masura ce catena
laterala este mai lunga, proprietatile
fizice se apropie de acelea ale
hidrocarburilor aciclice.
Spectrele in
infrarosu pot da anumite indicatii asupra
prezentei radicalului fenil cum si asupra
pozitiei unor substituenti in ciclu.
Astfel, cele doua benzi cu frecventa
aproape de 1600 cm(-1) si 1500 cm(-1) au
fost corelate cu vibratiile de alungire
din legaturile C-C din ciclul aromatic,
dupa cum benzile apropiate de 3030 cm(-1)
sunt caracteristice legaturilor C-H
aromatice.
Compusii
aromatici pot da spectre de absorbtie cu
cateva benzi in regiunea ultravioleta.
Astfel, benzenul si alchilbenzenii dau
doua benzi caracteristice aproape de 200
nm - 260 nm, dintre care prima, de mare
intensitate corespunde excitarii unui
electron pi din sistemul conjugat intr-un
orbital pi*. Aceasta banda este
intensificata si deplasata spre lungimi
de unda mai marei, cand in sistemul
conjugat, hidrogenii din ciclu sunt
inlocuiti prin grupe nesaturate. Astfel,
stirenul are o banda de absorbtie
caracteristica in ultraviolet la 244 nm.
Efecte similare sunt cauzate cand
substituentul in nucleul benzenic are
perechi de electroni neparticipanti in
conjugarea cu ciclul benzenic. De exemplu
fenolul are o banda la 210 nm sau
anilina, C6H5NH2, la 230 nm. A doua banda
din spectrul benzenului este de
intensitate mai slaba; ea este de
asemenea influentata de substituentii din
ciclu.
Orientarea
substituirii in nucleul benzenic
S-a constatat ca
un substituent prezent in nucleul
benzenic influenteaza nu numai
reactivitatea nucleului fata de reactant
(electrofil), dar determina si pozitia
unde se efectueaza atacul. Astfel
deosebim 2 tipuri de substituenti:
Substituenti
de ordinul I:
atasati unui nucleu aromatic orienteaza
substitutia in pozitiile orto si para. Se
formeaza astfel 2 produsi izomeri: orto
si para. Substituentii de ordinul I au la
atomul direct legat de nucleu numai
legaturi simple. Exemple:
R,OH,OR,NH2,X,NHR,NR2. Exceptii:-CH=CH2,
fenil.
Substituenti
de ordinul II:
atasati unui nucleu aromatic orienteaza
substitutia in pozitia meta.
Substituentii de ordinul II au la atomul
direct legat de nucleu legaturi duble sau
triple. Exemple: NO2, NO, CN, C C-R.
Exceptii: SO3H, -CX3, -NR3. C-R.
Exceptii: SO3H, -CX3, -NR3.
Utilizarile
arenelor
Benzenul este
hidrocarbura aromatica care se fabrica in
cantitatea cea mai mare pe plan mondial
datorita numeroaselor sale aplicatii:
obtinerea de fibre sintetice, cauciuc
sintetic, mase plastice.
Benzenul si unele hidrocarburi aromatice
sunt substante cancerigene.
Hidrocarburile aromatice polinucleare cu
nuclee condensate aplicate in cantitati
mici pe piele provoaca in aproximatic o
luna cancer. Majoritatea acestora se
gasesc in gazele de combustie ale
motoarelor, in fumul de tigara, dar apar
si la incinerarea deseurilor, in
incendiile din paduri sau din industrie,
la prepararea carnii prin prajire.
|