Alchenele
Hidrocarburile
aciclice care contin in molecula o dubla
legatura intre doi atomi de carbon se
numesc alchene. Alaturi de aceasta
denumire mai este obisnuita si denumirea
de olefine, data acestor hidrocarburi
datorita faptului ca derivatii lor
clorurati sau bromurati sunt lichide
uleioase. S-a mai folosit denumirea de
hidrocarburi etilenice, data acestei
serii dupa primul termen, etilena.
Structura
Cea mai simpla
alchena este etilena, C2H4, care contine
doi atomi de carbon legati printr-o dubla
legatura. Alchenele superioare pot fi
considerate rezultate din etilena prin
inlocuirea unui atom de hidrogen cu
radicali alchil, ca si in cazul formarii
hidrocarburilor saturate aciclice.
Astfel, omologul superior al etilenei
este propena, CH2=CH-CH3. Omologul
propenei este butena, C4H8. Dupa pozitia
pe care o ocupa dubla legatura in
molecula la butena se deosebesc trei
izomeri de pozitie.
Nomenclatura
Alchenele au numele
format prin inlocuirea terminatiei an
din numele alcanului cu alcelasi nuar de
atomi de carbon in molecula cu terminatia
ena.
De exemplu propan-propena, butan-butena.
Catena se numeroteaza astfel incat
pozitia dublei legaturi sa fie indicata
cu cel mai mic numar posibil. De exemplu:
CH3-CH2-CH2-CH=CH-CH3
- 2 hexena
Cei trei
izomeri de pozitie ai butenei se numesc
deci: 1-butena, 2-butena, 2-metilpropena.
Uneori se mai foloseste si indicarea
pozitiei dublei legaturi dupa numele
hidrocarburii. De exemplu: butena-1.
Radicalii monovalenti derivati de la
alchene au numele terminat in enil,
pozitia dublei legaturi fiind indicata,
daca este necesar, printr-un numar. De
exemplu: CH3-CH=CH- se numeste
1-propenil. CH3-CH=CH-CH2- se numeste
2-butenil. Ca exeptii se folosesc
denumirile:
vinil
pentru etenil: CH2=CH-
alil
pentru 2-propenil: CH2-CH-CH2-
izopropenil pentru
1-metilvinil: CH2-C-CH3
Formula
generala
Din cauza
dublei legaturi in moleculam alchenele au
doi atomi de hidrogen mai putin decat
hidrocarburile saturate respective; prin
urmare formula generala a acestor
hidrocarburi este CnH2n. Se observa seria
omoloaga a cicloalcanilor. Ele sunt deci
izomere de formula bruta.
Proprietati
fizice
La
temperatura camerei, alchenele cu C2-C4
sunt gaze, urmatoarele, cu C5-C18 sunt
lichide, iar cele cu mai mult de 18 atomi
de carbon sunt solide. Punctele de
fierbere sunt cu cateva grade mai scazute
decat cele ale alcanilor corespunzatori.
Densitatea lor este mai mare decat a
alcanilor respectivi, insa toate au o
densitate mai mica decat 1. Alchenele
sunt insolubile n apa, dar sunt miscible
cu dizolvatii organici.
Izomerie
Alchene pot
prezenta trei tipuri de izomerie si
anume: izomeri de catena (izomerii difera
prin catena), izomeri de pozitie (catena
este identica, dar difera pozitia
legaturii duble) si izomeri de functiune.
Izomeria geometrica apare la alchene
deoarece dubla legatura este rigida si nu
permite rotatia atomilor de carbon in
jurul acesteia. Izometrii geometrici
difera intre ei prin asezarea spatiala a
substituientilor in jurul dublei
legaturi. Conditia aparitiei izomeriei
geometrice este ca la fiecare atom de
carbon din dubla legatura sa exista
substituienti diferiti.
Nomenclatura izomerilor geometrici: se
stabilesc prioritatile substituientilor
legati de fiecare atom de carbon din
legatura dubla asfel: se compara Z-ul
atomilor direct legati de atomul de
carbon din dubla legatura. Cel care are
Z-ul mai mare va avea prima prioritate si
se noteaza cu 1, iar celalalt cu 2. Daca
au acelasi Z atunci se compara atomii
imediat urmatori. Comparatia se face pana
cand apare o deosebire. Substituient-ul
la care se gaseste Z-ul mai mare se
noteaza cu 1. Acest procedeu se aplica la
fiecare atom de carbon din dubla. Dupa
stabilirea prioritatilor, denumirea se
stabileste astfel: izomerul ce are
substuienti de aceeasi parte a legaturii
duble se noteaza cu Z (CIS), iar celalalt
care are substuienti de acelasi fel de o
parte si de alta a legaturii duble se
noteaza cu E (TRANS).
Spre exemplu, C4H8 are 6 izomeri:
1-butena, CIS 2-butena, TRANS 2-butena,
izobutena, ciclobutan, metilciclopropan.
Metode
de obtinere
1.
Descompunerea termica
CnH2n+2
 CmH2m+2 + CpH2p - cracare;
n=m+p, p >= 2 CmH2m+2 + CpH2p - cracare;
n=m+p, p >= 2
CnH2n+2 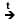 CnH2n + H2 - dehidrogenare CnH2n + H2 - dehidrogenare
2.
Hidrogenarea alchinelor
R-C C-R' + H2 C-R' + H2  R-CH=CH-R
(alchina) - reactia se face in prezenta
de Pd otravit cu saruri de Pb. R-CH=CH-R
(alchina) - reactia se face in prezenta
de Pd otravit cu saruri de Pb.
Exemple: CH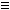 CH
+ H2 CH
+ H2  CH2=CH2 (etena) CH2=CH2 (etena)
CH3-C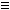 CH
+ H2 CH
+ H2  CH3-CH=CH2 (propena) CH3-CH=CH2 (propena)
3. Din
derivati halogenati vicinali prin
dehalogenare
derivat
halogenat + Zn  ZnX2 + alchena
(X=Cl,Br,I) ZnX2 + alchena
(X=Cl,Br,I)
Exemple: Cl-CH2-CH2-Cl
+ Zn  ZnCl2 + CH2=CH2 (etena) ZnCl2 + CH2=CH2 (etena)
4. Din
derivati monohalogenati prin
dehidrohalogenare (-HX)
derivat
monohalogenat 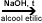 alchena + HX
(X=Cl,Br,I) alchena + HX
(X=Cl,Br,I)
Exemple: CH3-CH2-Cl 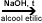 CH2=CH2 + HCl
(etena) CH2=CH2 + HCl
(etena)
Br-CH2-CH2-CH2-CH3
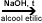 CH2=CH-CH2-CH3 (1
butena) CH2=CH-CH2-CH3 (1
butena)
Regula
lui Zaitev: la
eliminarea de HX din derivati
monohalogenati pt. care exista 2
posibilitati de indepartare a
hidrogenului, acesta se va indeparta de
la atomul de carbon vecin celui de care
este legat hidrogenul cel mai sarac in
hidrogen.
5. Prin
deshidratarea alcoolilor (-H2O)
alcool
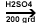 alchena + H2O alchena + H2O
Exemple: CH3-OH 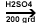 CH2=CH2 + H2O (etena) CH2=CH2 + H2O (etena)
CH3-CH2-OH
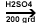 CH2=CH-CH3 + H2O
(1-butena) CH2=CH-CH3 + H2O
(1-butena)
Proprietati
fizice
Starea de
agregare a alchenelor poate fi gazoasa,
lichida sau solida in functie de masa lor
molara. Punctele de fierbere ale
alchenelor cresc, in general, cu
cresterea masei molare si sunt
comparabile cu ale alcanilor
corespunzatori.Alchenele sunt insolubile
in apa, dar se dizolva in solventi
organici (cloroform, benzen).
Reactii
chimie
1. Aditia
de H (hidrogenare)
alchena
+ H2  alcan alcan
Exemple: CH2=CH-CH3 +
H2  CH3-CH2-CH3 (propan) CH3-CH2-CH3 (propan)
CH3-CH=CH-CH3
+ H2  CH3-CH2-CH2-CH3 (nbutan) CH3-CH2-CH2-CH3 (nbutan)
2. Aditia
de X2 (halogenarea) XL Cl2, Br2, I2
alchena
+ X2  derivat halogenat vicinal derivat halogenat vicinal
Exemple:
CH2=CH-CH2-CH3 + Cl2  CH2Cl-CHCl-CH2-CH3
(1,2-diclorbutan) CH2Cl-CHCl-CH2-CH3
(1,2-diclorbutan)
CH2=CH2
+ Br2  CH2Br-CH2Br (1,2-dibrometan) CH2Br-CH2Br (1,2-dibrometan)
3. Aditia
de HX (HCl, HBr, HI)
alchena
+ HX  derivat monohalogenat derivat monohalogenat
Exemple: CH2=CH2 + HBr
 CH3-CH2-Br (bromura de etil) CH3-CH2-Br (bromura de etil)
CH3-CH2=CH-CH3
+ HCl  CH3-CH2-CHCl-CH3 (clorura de
sbutil) CH3-CH2-CHCl-CH3 (clorura de
sbutil)
CH2=CH-CH3
+ HI  CH3-CHI-CH3 (iodura de
izopropil) CH3-CHI-CH3 (iodura de
izopropil)
Regula
lui Markovnicov: la
aditia de HX la alchene nesimetrice, H se
aditioneaza la atomul din dubla cel mai
bogat in H, iar X-ul la cel mai sarac.
4. Aditia
de H2O (hidratare)
alchena
+ H2O 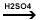 alcool alcool
Exemple: CH2=CH2
+ H2O 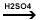 CH3-CH2-OH (alcool
etilic) CH3-CH2-OH (alcool
etilic)
CH2=CH-CH3
+ H2O 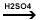 CH3-CHOH-CH3
(alcool izopropilic) CH3-CHOH-CH3
(alcool izopropilic)
CH2=CH2
+ H2SO4  CH3-CH2-SO3H +H2O CH3-CH2-SO3H +H2O CH3-CH2-OH (alcool etilic)
CH3-CH2-OH (alcool etilic)
5. Aditia
de HBr in prezenta de peroxizi
R-CH=CH2
+ HBr  R-CH2-CH2-Br R-CH2-CH2-Br
6. Aditia
de acid hipologenos (HOX)
Exemple:
CH2=CH2 + HOCl  CH2-OH-CH2-Cl
(2-clor, 1-hidroxoetan) CH2-OH-CH2-Cl
(2-clor, 1-hidroxoetan)
CH2=CH-CH2-CH3  CH2-OH-CH-Br-CH3
(1-brom, 2-hidroxopropan) CH2-OH-CH-Br-CH3
(1-brom, 2-hidroxopropan)
7. Reactia
de polimerizare
CH2=CH2
 (-CH2-CH2-)(n) - polietena /
polietilena - polimer (-CH2-CH2-)(n) - polietena /
polietilena - polimer
n = gradul de
polimerizare
La polimerizare,
lanturile nu ies toate de aceeasi
lungime. De aceea pentru n se da o
valoare medie; se
numeste grad
mediu de polimerizare.
8. Reactia
de oxidare
a)
Completa (arderea sau combustia)
CnH2n
+ O2  nCO2 + nH2O + Q nCO2 + nH2O + Q
C2H6
+ 3O2  2CO2 + 2H2O + Q 2CO2 + 2H2O + Q
b)
Cu O2 in prezenta de Ag / 250 grade
alchena
+ 1/2 O2 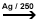 oxid de etena
(instabil) +H2O oxid de etena
(instabil) +H2O  diol diol
c)
Oxidarea blanda - Bayer: KMnO4, H2O sau
Na2SO3
alchena
+ [O] + H2O 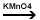 diol diol
Utilizarile
alchenelor
Etena si
propena sunt compusi organici produsi in
cea mai mare cantitate pe plan mondial.
Etena ocupa locul patru in productia
tuturor compusilor chimici (fiind
depasita numai de acid sulfuric, de azot
si de oxigen). Cele mai importante
transformari chimice ale etenei,
utilizate la scara industriala sunt:
polietenea, acidul acetic, PVC-ul.
Etena este produsa de plante si
stimuleaza coacerea fructelor, incoltirea
semintelor si maturizarea florilor.
|